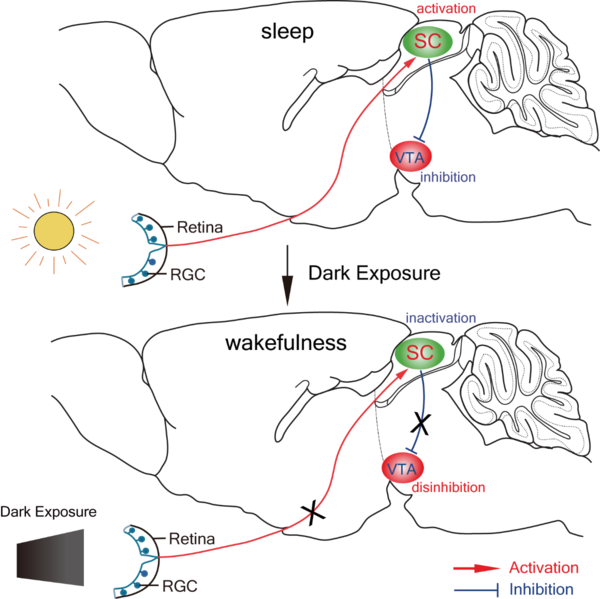
复旦大学黄志力团队发现黑暗暴露诱发小鼠觉醒的神经环路发表时间:2019-03-06 14:06作者:皮巍巍 与昼行的人类相反,夜行动物白天休息、夜晚活动。如果在白天解除小鼠睡眠期的光照,动物会快速清醒,但其机制不明。黄志力课题组发现,视网膜神经节细胞-上丘γ-氨基丁酸能神经元-腹侧被盖区多巴胺能神经元神经通路介导了急性黑暗暴露诱发小鼠觉醒效应,为临床治疗异常光照引起睡眠紊乱相关疾病提供了新思路。近日,该研究成果以《上丘γ-氨基丁酸能神经元在黑暗暴露诱发小鼠觉醒效应中起到关键作用》(“Superior Colliculus GABAergic Neurons Are Essential for Acute Dark-Induction of Wakefulness in Mice”) 为题【1】,发表于国际权威期刊《当代生物学》(Current Biology)。 博士生张泽、刘雯樱等利用转基因小鼠,结合光遗传和化学遗传学操纵、选择性损毁神经元及多导睡眠图记录等研究手段,发现特异性损毁上丘γ-氨基丁酸能神经元或腹侧被盖区多巴胺能神经元后,急性黑暗介导的动物促觉醒效应完全消失,揭示这两种神经元在急性黑暗介导的促觉醒效应中扮演着不可或缺的角色。通过病毒示踪、离体电生理并结合光遗传学方法研究神经环路发现,视网膜神经节细胞能够直接调控上丘γ-氨基丁酸能神经元的活性并与其形成单突触连接,上丘γ-氨基丁酸能神经元也通过单突触连接对腹侧被盖区多巴胺能神经元进行直接的功能性支配。阐明该神经环路机制,可能为治疗光照异常导致的生物节律紊乱和睡眠障碍等疾病提供新靶点。 该项目受到了国家自然科学基金委重点项目资助。
急性黑暗暴露诱发小鼠觉醒的神经环路机制 急性黑暗暴露取消视网膜对上丘(SC)γ-氨基丁酸能神经元的兴奋作用,进而解除SC对腹侧被盖区(VTA)多巴胺能神经元的抑制;VTA多巴胺能神经元兴奋,诱发觉醒。 视网膜神经节细胞, retinal ganglion cell, RGC; 上丘, superior colliculus, SC; 腹侧被盖区, ventral tegmental area, VTA
据悉,复旦大学上海医学院黄志力课题组长期从事睡眠与昼夜节律相关分子机制研究,发表110多篇高水平SCI原著论文,论文被广泛引用,黄志力教授连续入选中国论文被高引学者榜单。 在生物节律调控睡眠领域,2017年该团队发现照度≥20 lx的红光,与白光一样,能显著增加小鼠睡眠量;当红光照度降低到10 lx时,红光暴露不再影响睡眠量及睡眠结构【2】;2018年9月,该课题组在PNAS发表论文,发现了下丘脑室旁核和室旁下核存在次昼夜生物节律,揭示了次昼夜节律的产生位点和神经网络机制【3】。在睡眠神经环路机制研究方面,2017年发表在eLife上的论文,揭示尾壳核腺苷A2A神经元调控睡眠【4】;之后发现伏隔核中的多巴胺D1神经元控制动机性觉醒【5】,而A2A阳性神经元调节睡眠【6】。2018年发现吻内侧被盖区控制连接伏隔核的多巴胺能神经元活性,发挥强效促睡眠作用,有望成为睡眠开关【7】。
参考文献: 1. Zhang Z#, Liu WY#, Diao YP, Xu W, Zhong YH, Zhang JY, Lazarus M, Liu YY, Qu WM*, and Huang ZL*. Superior colliculus GABAergic neurons are essential for acute dark-induction of wakefulness in mice. Current Biology, 2019 Jan 15. pii: S0960-9822(18)31665-8. doi: 10.1016/j.cub.2018.12.031. 2. Zhang Z, Wang HJ, Wang DR, Qu WM and Huang ZL*. Red light at intensities above 10 lx alters sleep-wake behavior in mice. Light Science Application, 2017 May 6; e16231; doi:10.1038/lsa.2016.231 3. Wu YE, Enoki R*, Oda Y, Huang ZL*, Honma K, Honma S. Ultradian Calcium Rhythms in the Paraventricular Nucleus and Subparaventricular Zone in the Hypothalamus. Proc Natl Acad Sci U S A. 2018; 115(40):E9469-E9478. doi: 10.1073/pnas.1804300115. 4. Yuan XS, Wang L, Dong H, Qu WM, Yang SY, Cherasse Y, Lazarus M, Schifmann S, de Kerchove d'Exaerde A, Li RX* and Huang ZL*. Striatal adenosine A2A receptor neurons control active-period sleep via parvalbumin neurons in external globus pallidus. eLife, 2017, 2017 Oct 12;6. pii: e29055. doi: 10.7554/eLife.29055. 5. Luo YJ#, Li YD#, Wang L#, Yang SR, Yuan XS, Wang J, Cherasse Y, Lazarus M, Chen JF, Qu WM, and Huang ZL*. Nucleus accumbens controls wakefulness by a subpopulation of neurons expressing dopamine D1 receptors. Nature Communications, 2018 Apr 20;9(1):1576. doi: 10.1038/s41467-018-03889-3. 6. Oishi Y, Xu Q, Wang L, Zhang BJ, Takahashi K, Takata Y, Luo YJ, Cherasse Y, Schifmann S, de Kerchove d'Exaerde A, Urade Y, Qu WM, Huang ZL* and Lazarus M*. Slow-wave sleep is controlled by a subset of nucleus accumbens core neurons in mice. Nature Communications, 2017 Sep 29;8(1):734. doi: 10.1038/s41467-017-00781-4. 7. Yang SR*, Hu ZZ, Luo YJ, Zhao YN, Sun HX, Yin D, Wang CY, Yan YD, Wang DY, Yuan XS, Ye CB, Guo W, Qu WM, Cherasse Y, Lazarus M, Ding YQ, Huang ZL*. The rostromedial tegmental nucleus is essential for non-rapid eye movement sleep. PLoS Biology, 2018 Apr 13;16(4):e2002909. doi: 10.1371/journal.pbio.2002909.
(徐昕红供稿)
文章分类:
研究会新闻
|